血脑屏障(BBB)是基因组疗法脑部递送的主要挑战,其会限制多数药物(尤其是大分子DNA/RNA类治疗剂)进入CNS。当前的脑内递送方式(如脑实质内注射、鞘内注射)多为有创操作,存在感染等副作用风险;虽有核苷酸化学修饰、配体偶联或纳米颗粒等非病毒递送平台显示出潜力,但经静脉注射实现CNS疾病广泛治疗的疗效仍有待提升。
病毒平台(如工程化AAV)可经静脉注射跨越BBB实现CNS广泛递送,并能实现基因的持续表达,但免疫反应会限制重复给药效果;非病毒平台虽基因表达持续时间较短,但支持重复给药,二者在基因组疗法发展中具有互补作用,本文重点聚焦非病毒递送平台的研究进展。
脂质纳米颗粒(LNPs)
定义:脂质纳米颗粒(LNPs)是一种由脂质分子自组装形成的非病毒递送载体,经典配方包含可电离脂质/阳离子脂质、辅助脂质、胆固醇、PEG-脂质偶联物四种核心成分,通过微流控技术与DNA或RNA类治疗剂(如mRNA、ASO)混合后,可形成能包裹并保护核酸的纳米级颗粒,是当前基因组疗法中用于脑部及全身递送的关键平台之一[Fig.1]。
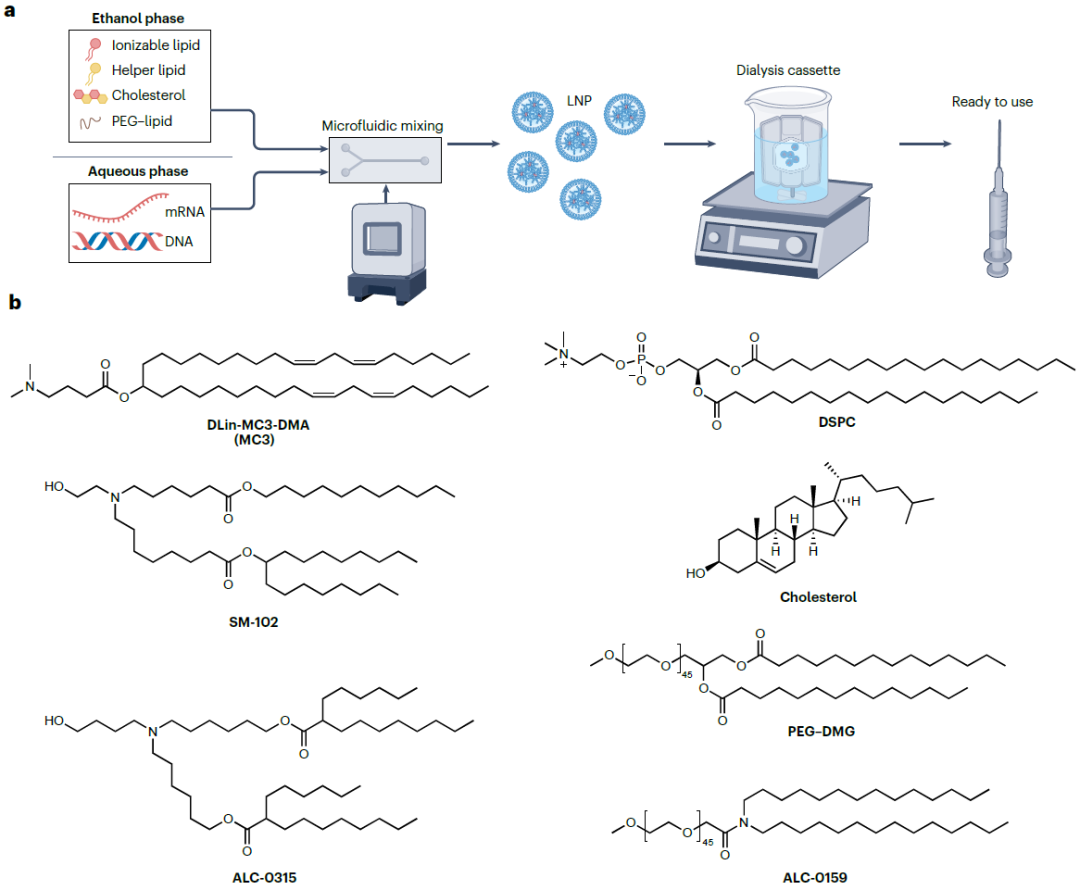 Figure 1 脂质纳米颗粒(LNP)的制备配方
Figure 1 脂质纳米颗粒(LNP)的制备配方功能
核酸保护与包裹:核心功能是高效包裹DNA或RNA,避免其在体内被核酸酶降解,维持治疗剂的结构稳定性与生物活性,为后续递送至靶细胞奠定基础。
细胞摄取与内体逃逸:通过可电离脂质的电荷作用促进细胞摄取,辅助脂质则帮助 LNPs 在进入细胞后突破内体膜(内体逃逸),将包裹的核酸释放到细胞质中,确保治疗剂能发挥基因调控作用(如mRNA翻译、ASO介导的基因沉默)。
脑部递送适配:经结构优化(如可电离脂质改造、表面修饰)或结合特定给药途径(如鞘内注射、聚焦超声辅助),LNPs可穿透血脑屏障(BBB)或直接作用于脑部局部区域,将核酸药物递送至脑内皮细胞、神经元、星形胶质细胞等靶细胞,用于中枢神经系统(CNS)疾病治疗。
优势
递送效率与临床验证:在mRNA疫苗领域已获广泛临床成功(如新冠mRNA疫苗),证明其良好的递送性能;经优化的LNPs(如MK16 BLNPs)静脉注射后,可编辑全脑16.7%的神经元和19.2%的星形胶质细胞,在胶质瘤、阿尔茨海默病等CNS疾病模型中展现出显著治疗潜力。
可设计性强:可通过调整可电离脂质结构、表面修饰(如偶联VCAM-1抗体、RVG29肽)或改变成分比例,优化LNPs的生物分布、BBB穿透性和细胞靶向性,适配不同脑部疾病的治疗需求。
支持重复给药:作为非病毒载体,LNPs引发的免疫反应(如中和抗体)较弱,可支持重复给药以维持长期治疗效果,这一点优于易引发免疫排斥的病毒载体。给药途径灵活:除传统静脉注射外,还可适配鞘内注射(靶向背根神经节)、脑实质内注射(局部治疗胶质瘤)、鼻内给药(非侵入性脑部递送)等多种途径,能根据疾病类型选择更精准的给药方式。
缺点
BBB穿透能力有限:未修饰的LNPs难以通过静脉注射有效跨越BBB,需依赖复杂的结构改造(如特殊可电离脂质设计)或外部辅助手段(如聚焦超声打开BBB),增加了研发难度与成本。
筛选与优化难度高:尽管有DNA条形码、Transwell模型等筛选技术,但LNPs的性能(如BBB穿透性、细胞靶向性)受脂质结构、配方比例等多因素影响,高效筛选和优化仍需大量实验验证,耗时耗力。
局部给药的侵入性:针对脑部的高效递送常依赖鞘内注射、脑实质内注射等侵入性途径,可能引发感染、组织损伤等副作用,限制了其在临床中的广泛应用(尤其需长期治疗的疾病)。
细胞靶向性待提升:现有LNPs虽能递送至脑部,但对特定细胞类型(如神经元vs星形胶质细胞)的选择性仍不足,部分LNPs主要富集于脑内皮细胞,可能影响治疗效率并增加脱靶风险。
聚合物
定义:聚合物是一类具有可设计结构的非病毒递送载体,通过化学合成或修饰可形成聚乙二醇(PEG)、聚乙烯亚胺(PEI)、聚β-氨基酯(PBAE)、树状大分子等多种类型;常通过conjugation技术连接肽、抗体、葡萄糖等靶向配体,或调整分子结构(如支化、线性),构建成能包裹DNA/RNA类治疗剂的纳米颗粒,是基因组疗法中实现脑部递送的重要平台之一[Fig.2]。
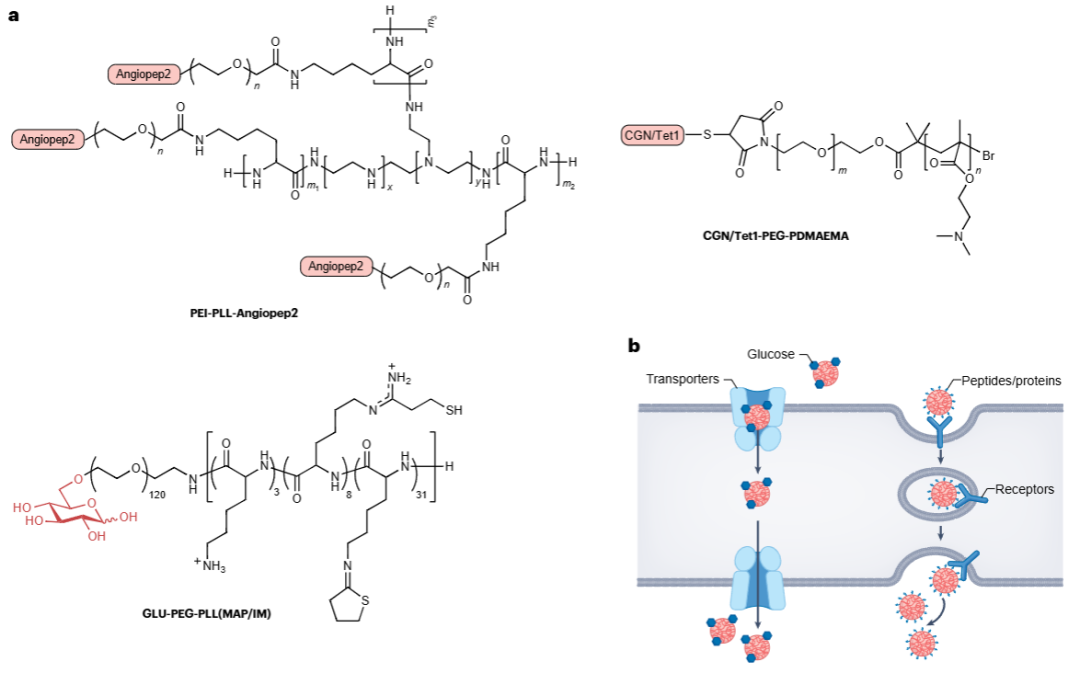 Figure 2 用于静脉注射脑部递送的聚合物化学结构
Figure 2 用于静脉注射脑部递送的聚合物化学结构功能
核酸负载与保护:通过正电荷与核酸的负电荷相互作用,或形成纳米级空腔结构,高效负载并包裹DNA质粒、siRNA、ASO等核酸药物,避免其被体内核酸酶降解,维持生物活性。
BBB穿透介导:经配体修饰(如偶联Angiopep-2肽、转铁蛋白受体抗体)后,可通过受体介导的转胞吞作用跨越血脑屏障(BBB);例如Angiopep-2能结合脑内皮细胞上的低密度脂蛋白受体相关蛋白1(LRP1),引导聚合物纳米颗粒进入脑部。
脑部靶向递送与基因调控:可将核酸药物递送至脑部特定细胞(如神经元、胶质瘤细胞),实现基因编辑、基因沉默或蛋白表达;如PBAE-111负载BDNF mRNA经脑室内注射,能在阿尔茨海默病小鼠模型中改善认知功能,PEI-PLL-PEG-Angiopep-2可递送“自杀基因”治疗胶质瘤。
优势
结构与功能多样性:可通过调整单体组成、分子量、电荷密度或引入功能性基团(如可降解linker、靶向配体),精准调控聚合物的溶解性、生物降解性、细胞靶向性,适配不同脑部疾病(如胶质瘤、帕金森病)的治疗需求。高转染效率与稳定性:部分聚合物(如PBAE-447)在原代胶质瘤细胞中transfection效率超60%,且冻干后仍能保持稳定性(-20℃下可保存2年以上),便于储存与临床应用。
低免疫原性与安全性:相较于病毒载体,聚合物引发的免疫反应(如中和抗体)较弱,且可通过化学修饰(如PEGylation)降低细胞毒性;例如支化PEI经二硫键修饰(PEI-SS-PEG)后,生物安全性显著提升。适配多种给药途径:除静脉注射外,还可通过脑实质内注射、脑室内注射实现局部精准递送;如DA-PEI(脱氧胆酸偶联 PEI)负载HMOX1质粒经脑实质内注射,能减轻啮齿类动物急性脑卒中损伤。
缺点
系统性脑部递送效率低:未修饰的聚合物难以通过静脉注射有效跨越BBB,需依赖复杂的配体修饰或局部给药,限制了其在需全身给药的广泛性CNS疾病(如全脑退行性疾病)中的应用。
部分聚合物毒性较高:传统阳离子聚合物(如未修饰的PEI)因电荷密度过高,易破坏细胞膜完整性,导致细胞毒性;虽可通过PEGylation、可降解结构设计降低毒性,但仍需平衡毒性与递送效率。
临床转化难度大:多数聚合物系统仍处于动物实验阶段,缺乏临床数据支持;且复杂的合成工艺(如精准的配体conjugation、结构调控)难以规模化生产,增加了临床转化的成本与难度。脑部分布不均:即使能穿透BBB,部分聚合物纳米颗粒仍倾向于富集在脑内皮细胞或特定脑区(如海马体),难以在全脑均匀分布,可能影响对广泛病变CNS疾病的治疗效果。
寡核苷酸偶联物
定义:寡核苷酸偶联物是一类通过化学修饰将寡核苷酸(如反义寡核苷酸ASO、小干扰RNA siRNA)与靶向配体(小分子、肽、抗体等)连接形成的递送系统,可通过配体介导的主动转运跨越生物屏障,是基因组疗法中针对中枢神经系统(CNS)疾病的重要非病毒递送平台,能提升寡核苷酸在脑部的富集效率与靶向性[Fig.3]。
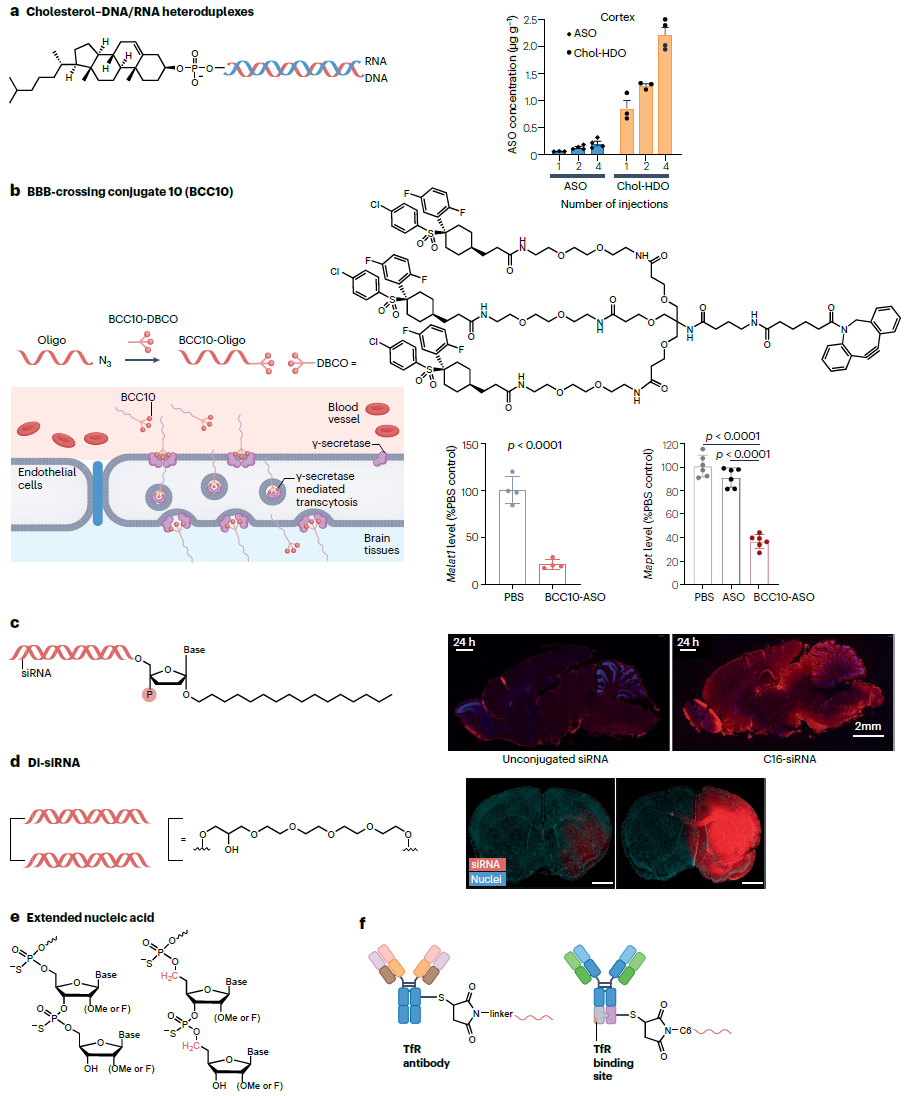 Figure 3 寡核苷酸向脑部高效递送的策略
Figure 3 寡核苷酸向脑部高效递送的策略功能
寡核苷酸保护与稳定性提升:通过化学修饰(如核苷酸骨架修饰、配体偶联)减少寡核苷酸被核酸酶降解的风险,延长其在体内的半衰期,确保能到达脑部发挥作用;例如胆固醇偶联的DNA/RNA异源双链可显著提升ASO在脑部的稳定性。
BBB穿透介导:配体(如靶向转铁蛋白受体的抗体、MK-0752衍生物)可与脑内皮细胞表面的受体或转运体结合,通过受体介导的转胞吞作用跨越血脑屏障(BBB);如BBB穿透偶联物BCC10可借助γ-分泌酶介导的转胞吞作用进入脑部,实现寡核苷酸的脑部递送。
脑部基因调控:将寡核苷酸递送至脑部特定细胞(神经元、星形胶质细胞等),通过ASO介导的基因沉默、siRNA介导的mRNA 降解等机制,调控靶基因表达;例如C16-siRNA经鞘内注射可在脊髓和脑部实现高达90%和75%的mRNA敲低,BCC10-ASO可在ALS小鼠模型中实现基因沉默。
优势
靶向性与递送效率高:配体的特异性结合能力使其能精准靶向脑部细胞或BBB上的转运体,提升脑部富集效率;如抗体-寡核苷酸偶联物(AOCs)靶向转铁蛋白受体时,脑部积累量较非靶向抗体高10倍,OTV平台(抗体偶联ASO)可在猕猴脑部实现约50%的靶mRNA下调。
临床应用基础扎实:已有多款寡核苷酸药物获批用于CNS疾病,如ASO类药物nusinersen(鞘内注射治疗脊髓性肌萎缩症)、tofersen(鞘内注射治疗ALS),验证了寡核苷酸在脑部疾病治疗中的可行性,为偶联物的临床转化提供参考。作用持久且给药灵活:部分偶联物(如C16-siRNA)经单次鞘内注射可在非人灵长类脑部维持> 75%的基因沉默效果达2.5个月,减少给药频率;同时可适配静脉注射、鞘内注射、脑室内注射等多种途径,适配不同疾病需求。
安全性较好:相较于病毒载体,寡核苷酸偶联物免疫原性低,不易引发中和抗体反应,且可通过优化配体与linker结构减少脱靶效应,降低全身毒性。
缺点
BBB穿透依赖配体,适用范围有限:多数偶联物需依赖特定配体(如Angiopep-2、转铁蛋白受体抗体)实现BBB穿透,而配体的选择受脑部受体分布限制,对缺乏特定受体的脑区或细胞难以有效靶向,限制了其应用场景。
合成工艺复杂且成本高:寡核苷酸与配体的精准偶联(如位点特异性conjugation)需复杂的化学合成技术,尤其是抗体-寡核苷酸偶联物(AOCs)的制备工艺难度大、产量低,导致生产成本较高,不利于大规模临床应用。
脑部分布不均与深度递送不足:即使能跨越BBB,部分偶联物仍难以在全脑均匀分布,对深部脑区(如丘脑、纹状体)的递送效率较低;例如二价siRNA在脑部的沉默效率从海马体的90%降至丘脑、纹状体的50%,影响广泛病变CNS疾病的治疗效果。
部分偶联物影响寡核苷酸活性:直接将配体偶联到寡核苷酸上可能改变其空间结构,降低与靶mRNA的结合亲和力;虽可通过DNA/RNA异源双链(如胆固醇偶联互补RNA)改善,但仍需平衡偶联效率与寡核苷酸活性。
总结
基因组疗法为中枢神经系统(CNS)疾病(如神经退行性疾病、脑肿瘤)的治疗提供了变革性方向,但其临床应用的核心瓶颈仍在于血脑屏障(BBB)的限制——多数DNA/RNA类治疗剂难以穿透BBB,且现有递送方式(如脑实质内注射)存在侵入性风险。脂质纳米颗粒(LNPs)、聚合物、寡核苷酸偶联物三类非病毒平台通过化学策略优化,已成为突破脑部递送障碍的核心工具。
未来研究仍需进一步通过化学设计提升递送效率与特异性,例如:开发新型可电离脂质、聚合物骨架或寡核苷酸配体,增强BBB穿透能力与细胞选择性;利用机器学习工具结合递送数据,理性设计载体结构,减少筛选成本;优化linker化学(如biodegradable linker),平衡偶联稳定性与药物释放效率,降低脱靶风险。新兴递送平台的探索:除现有三类平台外,硅纳米颗粒(可靶向递送Cas9-sgRNA)、细胞外囊泡(如含逆转录病毒样衣壳的外泌体)等新兴载体,凭借高生物相容性与靶向潜力,有望成为脑部递送的补充工具,但需解决规模化生产与质量控制问题。
原文链接:
https://doi.org/10.1038/s41570-025-00770-y
参考文献
Li H, Yu C, Markovic T, Nestler EJ, Dong Y. Chemical strategies for brain delivery of genomic therapy. Nat Rev Chem. 2025 Dec;9(12):841-854. doi: 10.1038/s41570-025-00770-y. Epub 2025 Nov 25. PMID: 41291238.
编译作者:Young(brainnews创作团队)
校审:Simon(brainnews编辑部)